उप- सहसंयोजक यौगिक
प्र 1 निम्नलिखित में कौन सा आयन रंगहीन है ?
(a) Cu+ (b) Co2+ (c) Ni+2 (d) Fe+3
प्र 2 K4[Fe(CN)6] का IUPAC नाम है।
(a) पोटेशियम फेरासायनाइड (b) पोटैशियम फेरीसायनाइड
(c) पोटेशियम हैक्सासायनो फेरेट (d) पोटैशियम हेक्सासायनोफेरेट
प्र 3 निकेल का [Ni(Co)4] में ऑक्सिकरण अवस्था होती है।
(a) 4 (b) 0 (c) 2 (d) 3
प्र 4 K4[Fe(CN)6] है –
(a) डबल साल्ट (b) जटिल लवण (c) अम्ल (d) भस्म
प्र 5 निम्न में से किसकी आकृति चतुष्कफलकीय होती है ?
(a) [Ni(CN)4]2- (b) [Pd(CN)4]2- (c) [Pt(Cl)4]2- (d) [Ni Cl4]2-
प्र 6 C2 अणु में σ और π बन्धन की संख्या है
(a) 1σ और 1 π (b) 1 σ और 2π
(c) सिप्फ 2 π (d) 1 σ और 3π
प्र7 लिगेण्ड सक्षम होते हैं जो कम से कम –
(a) एक जोड़ी इलेक्ट्रॉन प्रदान कर सकते हैं।
(b) एक इलेक्ट्रॉन प्रदान कर सकते हैं।
(c) तीन इलेक्ट्रॉन प्रदान कर सकते हैं।
(d) इनमें से सभी।
प्र 8 वह संकमण धात् जो जिगलर – नाटा उत्प्रेरक के रूप में काम में लाया जाता है –
(a) TI (b) Th (c) Ti (d) Te
प्र 9 मोहर लवण का सूत्र है
(a) FeSO4. TH20 (b) FeSO4 . (NH4)2 SO4
(c) FeSO4 (NH4)2 .6H20 (d) FeSO4. 5H20
प्र 10 समन्वयी संख्या छः (6) रखने वाले संकुल का उदाहरण है –
(a) INi (Co)4] (b) [Cu (NH3)4] SO4
(c) Fe (Co)5] (d) Co (NH3)4]Cl3
उत्तरमाला –
1 (अ, 2 (द), 3 (ब) , 4 (ब), 5 (द), 6 (ब), 7 (अ), ৪ स, 9 (सो, 10 (द)
लघुत्तरात्मक प्रश्न –
प्र 1 Ni (Co)4 में संकरण अवस्था क्या है ?
उत्तर – SP3
प्र 2 क्लोरोफिल में कौनसा तत्व पाया जाता है ?
उत्तर Mg
प्र 3 [K3 Fe (CN)6] में केन्द्रीय धातु आयनन् का ऑक्सीकरण अंक व उपसहसंयोजक संख्या बताइये ?
उत्तर –[K3Fe (CN)6]
3 [+1] + 1 [x] + 6[-1] =0
3+x-6 = 0
X =3
अतः Fe आयन का ऑक्सीकरण अंक +3 है। Fe आयन से 6 CN– जुड़े हैं अतः उपसहसंयोजक संख्या 6 है।
प्र 4 निरस्न लिगैण्डो में एक दन्तुक एवं द्विदन्तुक लिगैण्ड को पहचानिए।
(a) En (b) CN- (c) Acac (d) Dmg
(a) en – ethylenediamine – द्विदन्तुक
(b) CN – cyanide एक दन्तुक
(c) Acac – acetylacetonato – द्विदन्तुक
(c) Dimethylglyoximinoto द्विदन्तुक
प्र 5 उपसहसंयोजक यौगिक K2|Zn(OH)4] का IUPAC नाम दीजिये ।
उत्तर – पोटेशियम टेट्रा हाइड्रोक्सोजिकेट [II]
प्र 6 प्रत्येक को एक उदाहरण देकर समझाइये।
(a) होमोलेप्टिक संकुल (b) हेटरोलेप्टिक संकुल
(c) किलेट लिगेण्ड (d) कैंसर उपचार प्रयुक्त संकुल
उत्तर (a) होमोलेप्टिक संकुल – ऐसे संकुल यौगिक जिसमें धातु परमाणु / आयन केवल एक प्रकार के दाता परमाणु से जुडे हो उन्हें होमोलेप्टिक संकुले कहते हैं।
जैसे – [Co (NH3)6]+3 , [Fe (CN)6]+4
(b) हेटरोलेप्टिक संकुल – ऐसे संकुल यौगिक जिसमें धातु परमाणु / अयन दो या दो से अधिक प्रकार के दाता परमाणुओं से जुड़ा हो, उन्हें हेटरोलेप्टिक संकुल कहते हैं।
जैसे – [Cr (H20)5CI]+2
(c) किलेट लिगेण्ड – वे लिगेण्ड जिनमें दो या आअधिक दाता परमाणु उपस्थित होते हैं, जो केन्द्रीय धातु परमाणु/ अयन के साथ उपसहसंयोजक बंध बनाकर एक वलय संरचना का निर्माण करते हैं इन्हें किलेट लिगेण्ड कहते है तथा प्राप्त वलय को किलेट वलय कहते हैं।
जैसे एंथिलीन डाइएमीन (en) ऑक्सलेटो आयन (ox) आदि।
द. कैंसर उपचार में प्रयुक्त संकुल – [Pt (NH3)]CI2 संकुल यौगिक को सिस-प्लाटिन कहते हैं। यह एंटी ट्यूमर कर्मक के रूप में कैंसर के उपचार में काम आता हैं।
प्र 7 निम्नलिखित संकुल यौगिकों के IUPAC में नाम दीजिये।
(a)[Co (en)3]3+ (b) K2 [Zn (OH)4]
उततर (a)[Co (en)3]3+ ट्रिस एथिलीन डाई एमीन कोबाल्ट आयन
(b) K2 [Zn (OH)4] पोटेशियम टेटाहाइड्रोक्सो जिकेट
प्र 8 निम्नलिखित संकुल यौगिकों के IUPAC नाम लिखिए।
(a) [CoCI2 (en)2]CI (b) K3 [Fe (CN)6]
उत्तर – (a) [CoCI2 (en)2]CI डाई क्लोरीडो बिस एथिलीन डाइएमीन कोबाल्ट क्लोराइड
(b) K3 [Fe (CN)6] पोटेशियम हेक्सा सायनो फेरेट
प्र 9 समपक्ष [CoCl2 (en)2]+ एवं [Co (NH3)3 (NO2)3] समावयवियों की संरचना दीजिए।
उत्तर –
प्र 10 उभयदंती लिगेण्ड का एक उदाहरण्ण देकर बताइये कि यह उभयदंती क्यों कहलाता है?
उत्तर – वे लिंगेण्ड जिनमें दो प्रकार के दाता परमाणु उपस्थित होते हैं, लेकिन एक समय में केवल एक ही परमोणु दाता का कार्य करता है, ऐसे लिगेण्ड को उभयदंती लिगेण्ड कहते हैं।
C≡N सायनाइड लिगेण्ड है, जिसमें C दाता परमाणु है।
N ≡ C आइसो सायनाइड लिगेण्ड है, जिसमें N दाता परमाणु है।
अतः CN एवं NC उभयदंती हैं। इसी प्रकार NO2 एवं 0-N=0 (नाइट्रो एवं नाइट्राइट) उभयदंती लिगेण्ड है।
प्र 11 संकुल यौगिक K3[Fe(C2O4)3] में केन्द्रीय धातु परमाणु की ऑक्सीकरण संख्या एवं उपसहसंयोजन संख्या बताइये।
उत्तर – K3[Fe(C2O4)3] संकुल यौगिक में Fe केन्द्रीय धातु परमाणु है।
+1 (3) + 1 (x) +3 (-2) = 0
+3+x-6 =0
X=+6 -3=+ 3
यह Fe का ऑक्सीकरण अंक है।
ऑक्सलेट एक द्विदंत्क लिगेण्ड है। अतः Fe की उपसहसंयोजन संख्या 3X2 =6 है।
प्र 12 धातुओं के शुद्विकरण क्षेत्र में उपसहसंयोजन यौगिक का अनुप्रयोग एक उदाहरण के साथ समझाइये
उत्तर – निकिल के शोधन की माण्ड विधि में निक्रिल की किया कार्बन मोनो ऑक्साइड के कराने पर निकिल टेट्रा कार्बोनिल की वाष्प बनती है जो एक संकुल यौगिक है। इसे गर्म करने पर यह पुनः विघटित होकर शुद्ध निक्रिल देता है।
Ni + 4Co → Ni (Co)4 → Ni + 4Co
प्र 13 (a) [Cr (H2O)4 Br2]Cl– के आयनन समावयव का सूत्र दीजिये।
(b) मरक्यूरी देट्रा थायो सायनेटो कोबाल्टेट [II ] की संरचना बनाइये।
(c) VBT के आधार पर [Ni (CN)4]-2 आयन निम्न चक्रण संकुल यौगिक बनाता हैं। समझाइये।
उत्तर – (a) [Cr (H2O)4 Br2]Cl– का आयनन समावयव होगा – [Cr (H2O)4 BrCI] Br
(b) यौगिक की संरचना होगी Hg [Co (SCN)4]
(c) Ni(CN)4]-2 में Ni का ऑक्सीकरण अंक = +2 एवं उपसहसंयोजन संख्या 4 है।
Ni(CN)4]-2 में Ni का ऑक्सीकरण अंक = +2 एवं उपसहसंयोजन संख्या 4 है।
Ni+2= [Ar]3d7 4s0 4p0
VBT के अनुसार CN– एक प्रबल क्षेत्र लिगेण्ड है जो Ni+2 आयन के अयुग्मित इलेक्ट्रॉनों का युग्मन कर देता है एवं एक कक्षक रिक्ति हो जाता है ।
यह आन्तरिक d कक्षक संकरण में भाग लेता है। अतः यह निम्न चक्रण संकुल यौगिक बनाता है। अयुग्मित इलेक्ट्रॉन नहीं होने के कारण यह प्रतिचुम्बकीय होगा।
प्र 14 वर्नर सिद्धान्त द्वारा प्रस्तावित् धातु आयनों की प्राथमिक एवं द्वितीयक संयोजकता की परिभाषा लिखिये।
उत्तर वर्नर सिद्धान्त के अनुसार प्राथमिक संयोजकता आयनिक होती है और ऋणायनों से संतुष्ट रहती है जबकि द्वितीयक संयोजकतता अनआयनिक होती है। यह उदासीन अणुओं या ऋणायन से संतुष्ट रहती हैं यह उपसहसंयोजन संख्या के बराबर होती है। इसे बड़े कोष्ठक में रखकर प्रदर्शित करते हैं। जबकि प्राथमिक संयोजकता कोष्ठक से बाहर होती है। द्वितीयक संयोजकता का मान धातु के लिये निश्चित
होता है।
उदाहरण -jCo (NH3)]6Cl3 में प्राथमिक संयोजकता 3 है एवं द्वितीयक संयोजकता 6 है।
प्र 15 बंधनी एवं आयनन समावयवता को परिभाषित कीजिए।
उत्तर – यह समावयवता उभयदंती लिगेण्डउ युक्त उपसहसंयोजक यौगिकों में पाई जाती है। ये यौगिक एक तरह से कियात्मक समूह समावयवी होते हैं । इसे बंधनी समावयवता कहते हैं।
जैसे – (a) M-0-N= 0 एवं M-N O O
(b) M- S – C ≡ N एवं M-N=C= S
इसमें दोनों यौगिक भिन्न-भिन्न होते हैं। जबकि आयनन समावयवता में आयन और लिगेण्ड आपस में अपना स्थान बदल लेते हैं। जिससे विलयन में भिन्न-2 आयन प्राप्त होते हैं।
जैसे – [Co (NH3)5 SO4] Br विलयन में लाल रंग एवं [Co (NH3)5 Br]SO4 विलयन में बैंगनी रंग
प्र 16 संकुल यौगिकों द्वारा ज्यामितिय समावयवता दर्शनि हेतू आवश्युक शर्ते बताइये।
उत्तर – (a) यह हेटोलेप्टिक संकुलों में पायी जाती है।
(b) उपसहसंयोजन संख्या 4 एवं 6 वाले यौगिक जिनमें लिगेण्डों की ज्यामितिय व्यवस्थाएं भिन्न – भिन्न हो।
(c) [MX2L2] प्रकार के वर्ग समतलीय् यौगिक यह समावयवता देते हैं। यहां X एवं L एक दन्तुक लिगेण्ड हैं। जैसे)- [Pt (NH3) Cl2]
(d) [MX4L2) प्रकृार के अष्टफलकीय यौगिक भी यह समावयवता देते हैं। जैसे – [Co (NH3)4 Cl2]+
प्र 17 निम्न उपसहसंयोजक यौगिकों के सूत्र लिखिये।
(a) टेट्रा एमीन एक्वा क्लोरिडो कोबाल्ट क्लोराइड
(b) पोटेशियम ट्राइ ऑक्सलेटो जिंकेट
(c) डाइक्लोरिडो बिस एथेन 1, 2 – डाइ एमीन कोबाल्ट
(d) मरक्यूरी टेट्राथायो सायनेटो कोबाल्टेट
उत्तर – (a) [Co (NH3)4 (H20) CI] Cl2
(b) K4[Zn (C2O4)3]
(c) [Co (en)2 Cl2]+
(d) Hg [Co (SCN)4]
प्र 18 निम्नलिखित को समझाइये
(a) प्रबल क्षेत्र एवं दूर्बल क्षेत्र लिगेण्ड
(b) आन्तरिक एवं बाह्य कक्षक सकुल
(c) पश्च आबन्धन
(d) रंग परिवर्तित करने वाले कारकों के नाम्
उत्तर – (a) प्रबल क्षेत्र लिंगेण्ड यदि लिगेण्ड प्रबल इलेक्ट्रॉन युग्म दाता हो तो यह धातु में उपस्थित अयुग्मित इलेक्ट्रोंन का युग्मन कर देता है क्योंकि प्रबल क्षेत्र लिगेण्ड के लिये व्रिपाटून उर्जा ∆0 का मान युग्मन उर्जा से अधिक होता है अर्थात् ∆0 > π इस प्रकार आन्तरिक d-कक्षक रिक्त हो जाता है, जो
संकरण में भाग लेते हैं और बनने वाले संकुल को उच्च चक्ण संकुल कहते हैं।
(b) दुर्बल क्षेत्र लिगेण्ड यदि लिगेण्ड दुर्बल इलेक्ट्रॉन युग्म दाता हो तो यह धातु के अयुग्मित de – का युग्मन नहीं कर सकता है। इसमें अयुग्मित इलेक्ट्रॉन अधिक रहने से चुम्बकीय आघूर्ण का मान बढ़ता है।
दुर्बल क्षेत्र लिगेण्ड के लिये ∆0 का मान π से कम होता है अर्थात ∆0 > π इस प्रकार बाह्य d- कक्षक संकरण में भाग लेते हैं और बनने वाले संकुल को उच्च चक्रण संकुल कहते हैं।
(b) आन्तरिक एवं बाह्म कक्षक संकुल प्रबल क्षेत्र लिगेण्ड की उपस्थिति में आन्तरिक कक्षक रिक्त हो जाते हैं, जो संकरण में भाग लेते हैं। अतः बनने वाले संकुल को आन्तरिक कक्षक संकुल या निम्न चक्रण संकुल कहते हैं। यहां संकरण होता है।
दुर्बल क्षेत्र लिगेण्ड की उपरि्थिति में बाह्य d- कक्षक रिक्त रहते हैं जो संकरण में भाग लेते हैं। अतः बनने वाले संकुल को बाह्य कक्षक संकुल या उच्च चक्रण संकुल कहते हैं। यहां संकरण sp3d2 होता है।
(c) पश्च आबन्धन – धातु के इलेक्ट्रॉन युग्म युक्त असंकरित d- कक्षक, लिगेण्ड के रिक्त बंधी या विपरित बंधी कक्षकों से अतिव्यापन करके π बंध बनाते हैं इसे पश्च आबंधन कहते हैं। इस प्रकार σ बंध बनने के कारण धातु आयन पर एकत्रित त्णावेश का धातु एवं लिगेण्ड पर π बन्धन के द्धारा पनः वितृरण हो जाता है।
(d) किसी संकुल के रंग को प्रभावित करने वाले कारक निम्तलिखित हैं –
क. लिगेण्ड की प्रकृति खू धातु आयन पर आवेश
ग. सकुल की ज्यामिति घ d- इलेक्ट्रॉनों की संख्या
प्र 19 निकिल के निम्न चक्रण के अष्टफलकीय संकुल यौगिक ज्ञात नहीं हैं, कारण बताइये।
उत्तर – निकिल प्राय +2 अवस्था में संकूल बेनाता है जिसका विन्यास d84s0 होता है। इसमें प्रबल क्षैत्र लिगेण्ड की उपस्थित्ि में भी इलेक्ट्रॉनों का युग्मन नहीं होता, जिससे कक्षक रिक्त नहीं होते हैं। अतः ब्राह्मतम d- कक्षक संकरण में भाग लेते हैं। इसमें Sp3d2 संकरण हौता है और उच्च चक्रण संकुल बनता है।
प्र 20 द्विक लवण एवं संकुल में अंतर समझाते हुए प्रत्येक का एक-एक उदाहरण दीजिये।
|
द्विक लबण |
संकुल यौगिक |
|
इनका निर्माण दो साधारण लवणों के सममोलर अ्नुपात में मिलाने से होता है। |
इनका निर्माण दो साधारण लवणों को सममोलर अ्नुपात में मिलाने से हो भी सकता है और नहीं भी । |
|
इसका अस्तित्व सिर्फ ठोस अवस्था में होता है। |
ये ठोस एवं विलयन दोनों अवस्थाओं में होते हैं। |
|
ये जलीय विलयन में दो धनायन एवं एक ऋणायन देते हैं। |
ये दो आयनों में बदलते हैं। |
|
इनमें धातु आयन अपनी सामान्य संयोजकता प्रदर्शित करते हैं। |
इनमें धातु की संयोजकता भिन्न होती है। |
|
इनके गुण उपस्थित संघटक आयनों के गुण होते हैं । |
जलीय आयनों के गुण उपस्थित संगटकों के गुणों से भिन्न होते हैं। |
|
उदाहरण- KCIMgCl2.6H20 K2SO4. Al2 (SO4)3. 24H20 |
उदाहरण- K4 [Fe (CN)6] [CO (NH3)6]Cl3 |
अध्याय 10 हैलो ऐल्केन तथा हैलोएरीन
प्र. हैलो ऐल्केन व हैलो एरीन में विभेद कीजिये
ऐलिफैटिक तथा ऐरोमैटिक हाइडोकार्बनों के हाइडोजन परमाणुओं का प्रतिस्थापन हैलोजन परमाणुओं द्वारा होने से बने यौगिकों को कृमशः हैलोऐल्केन तथा हैलोएरीन कहते हैं |
प्र.2 ऐलिलिक हैलाइड तथा वाइनिलिक हैलाइड का एक – एक उदाहरण दीजिये।
CH2=CH–CI (वाइनिल क्लोराइड) क्लोरोएथीन
CH2=CH–CH2-Cl (ऐलिल क्लोराइड) 3-क्लोरो-प्रोपइन
प्र.3 कारण बताइये – ऐल्कल हैलाइड प्राप्त करने के लिये थायोन्तिल क्लोराइड को प्राथमिकता दी जाती है।
थायोनिल क्लोराइड की अभिक्रिया ऐल्कोहॉल से करवाने पर ऐल्किल हैलाइड के साथ दो गैसें SO2 तथा HCl प्राप्त होती है तथा दोनों आसानी से निकल जाती हैं।
प्र.4 फिंकेल्स्टाइन अभिक्रिया का रासायनिक समीकरण लिखिये ।
R- X + Nal → R- I + 4NaX
प्र.5 स्वार्ट्स अभिक्रिया का रासायनिक समीकरण लिखिये ।
H3C-Br + AgF →H3C– F + AgBr
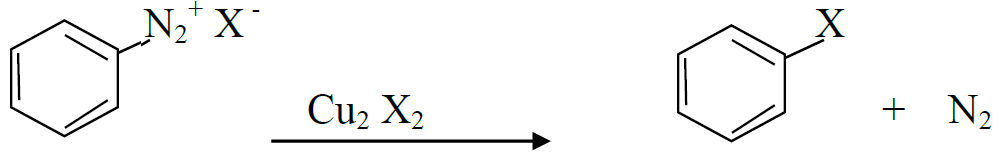
प्र. 6 सैन्डमायर अभिकिया का रासायुनिक समीकरण लिखिये।
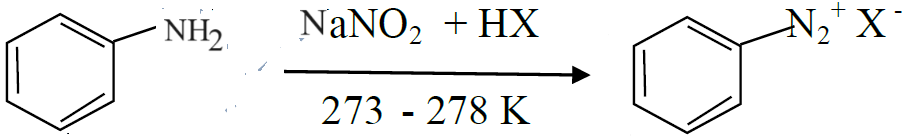
एनिलिन् बेन्जीन डाईऐजोनियम हैलाइड
प्र. 7 कारण बताइये : ऐल्किल क्लोराइड, ऐल्किल ब्रोमाइड, ऐल्किल आयोडाइडों के क्वथनांक समान द्रव्यमान वाले हाइडोकार्बनों के क्वथनांकों से अधिक होते है-
उच्च धुवता और जनक हाइडोकार्बन की तुलना में उच्च आणविक द्रव्यमान होने के कारण हैलोजन व्युत्पन्नों में प्रबल अन्तराआणविक आकर्षण बल होते हैं। अतः इनके क्वथनांक संगत हाइडोकार्बन से अधिक होते हैं।
प्र. 8 क्वथनांकों के घटते कम में व्यवस्थित कीजिये –
R Br. R C1, RF, RI
RI > RBr > RCI > RF
प्र. 9 हैलोऐल्केन की जल में विलेयता बहुत कम होती है । क्यों ?
हैलोएल्केन को जल में घोलने के लिये उर्जा की आवश्यकता हौती है। जिससे कि हैलो ऐल्केन के अणुओं के मध्य उपस्थित आकर्षण को तथा जल के अणुओं के मध्य उपस्थित आकर्षण को तथा जल के अणुओं के मध्य हाइडोजन आबंध को, तौडा जा सके। हैलोऐल्केन तथा जल के अणुओं के मध्य नए आकर्षण बलों के बनने से कम उर्जा निर्गमित होती है। अतः हैलो ऐल्केन की जल में विलेयता कम होती है।
प्र. 10 किन्हीं दो उभयदन्ती नाभिकरागी स्पीशीज के उदाहरण दीजिये
–C≡ N ↔C≡N– साईनाईड आयन
–O-N=0 नाइटाईट आयन
प्र. 11 SN1 वSN2 में कोई तीन अंतर बताइये ।
|
SN1 |
SN2 |
|
यह अभिक्रिया दौ पदों में होती है। |
यह एक पद में होती है। |
|
इसमें कार्बोकेटायन मध्यवती बनता है। |
इसमें काल्पनिक संक्रमण अवस्था मानी जाती है। |
|
यह प्रथम कोटि की अभिक्रिया है। |
यह द्वितीय कोटि की अभिकिया है। |
प्र. 12 बेन्जिलिक कार्बोकैटायन की अनुनादी संरचना बनाइये।
प्र. 14 बढती हुई क्रियाशीलता के कम में व्यवस्थत कीजिये।
RBr, RI, RCI, RF
RI > R- Br > R- CI > R- F
प्र. 16 ग्रीन्यार अभिकर्मक में उपस्थित विभिन्न बंधों को समझाइये।
ग्रीन्यार अभिकर्मक में कार्बन मैग्नीशियम बंध सह संयोजक आबन्ध होता है परन्तु विद्युतधनी मैग्नीशियम के इलेक्टॉन आकर्षित करने के कारण यह आबेन्ध अत्यधिक ध्रुवीय होता है। मैग्नीशियम तथा हैलोजन आबंध आवश्यक रूप से आयन्िक होता ळें

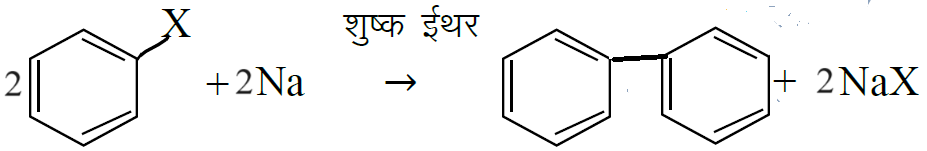
प्र 17 वुर्टज अभिक्रिया का रासायनिक समीकरण दीजिये।

शुष्क ईथर
2RX +2Na RR + 2NaX
प्र 18 क्लोरोबेन्जीन की अनुनादी संरचना बनाइये।
प्र 19 कारण दीज़िए – ऐरिल हैलाझड नाभिकरागी प्रतिस्थापन अभिक्रिया के प्रति कम क्रियाशील होते हैं।
- अनुनाद प्रभाव- अनुनाद के कारण C-CI आबंध में आंशिक द्विबंध के गुण आ जाते हैं जिसके परिणामस्वरूप हैलोएल्केन की तुलना में हैलोएरीन में आबंध विदलन अपेक्षाकृत कम होता है।
(b) हैलोएरीन में अधिक S गुणयुक्त Sp° संकरित कार्बन अधिक विद्युत ऋणात्मक होता है। अतः C-X आबंध के इलेक्टॉन युगल को अपेक्षाकृत अधिक सुदृढता से थाम सकता है ।
स फेनिल धनायन अनुनाद के द्वारा स्थायी नहीं हो पाए”
प्र 20 फीडेल काफट अभिक्िया का रासायनिक समीकरण लि ै ।

प्र 21 बुर्टज-फिटिंग-अभिक्रिया का रासायनिक समीकरण लिखिये

प्र 22 फिटिग अभिकिया का रासायनिक समीकरण लिखिये ।
प्र 23 फेऑन किसे कहते हैं ?
मेथेन व एथेन के क्लोरोफलुओरो व्युत्पन्न संयुक्त रूप से फेऑन कहलाते हैं।
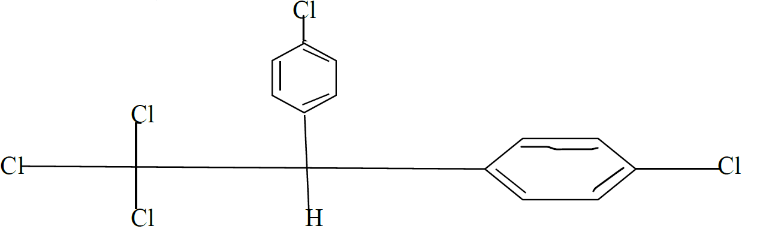
प्र 24 DDT का पूरा नामं व संरचना बताइये।
डाइक्लोरो डाइफेनिल टाइक्लोरो एथेन
ÇI
प्र 26 ध्रुवण घूर्णक यौगिके किसे कहते हैं ?
कुछ यौगिकों के विलयत में से समतल ध्ुवित प्रकाश गुजारे जाने पर यह इस प्रकाश के तल को घूर्णित कर देते हैं। इस प्रकार के यौगिकों को ध्रुवण घूर्णक यौगिक कहते हैं।
प्र 27 काइरलता किसे कहते हैं ?
वे वस्तुएं जो अपने दर्पण प्रतिबिंब पर अध्यारोपित नहीं होती काइरल कहलाती हैं तथा इस गुण को काइरलता कहते हैं । उदाहरण : अपने हाथ का दर्पण प्रतिबिंब
प्र 28 रेसिमीकरण किसे कहते हैं ?
असममित कार्बन से जुडे बंध के टूटने पर प्राप्त दोनों यौगिक (जिसमें विन्यास सुरक्षित रहता है व विन्यास का प्रतिलोमन होता है) दोनों यौगिक 50 : 50 अनुपात में प्राप्त होते हैं तो इस प्रकरिया को रेसिमीकरण कहते है।
कक्षा : 12वी
विषय : रसायन विज्ञान (Chemistry)
अध्यायः ऐल्कोहॉल, फीनॉल व ईथर
‘प्रश्न 1. ऐल्कोहॉल व ईथर का सामान्य सूत्र है-
उत्तरः ऐल्कोहॉल CnH2nOH
ईथर CnH2n+2O या R-O-R
प्रश्न 2. फीनॉल वायु में खुला छोड़ने पर क्या बनाता है?
उत्तरः फीनॉल वायु में खुला छोड़नेपर मन्दगति से ऑक्सीकृत होकर क्विनोन युक्त रंगीन मिश्रण बनाता है।
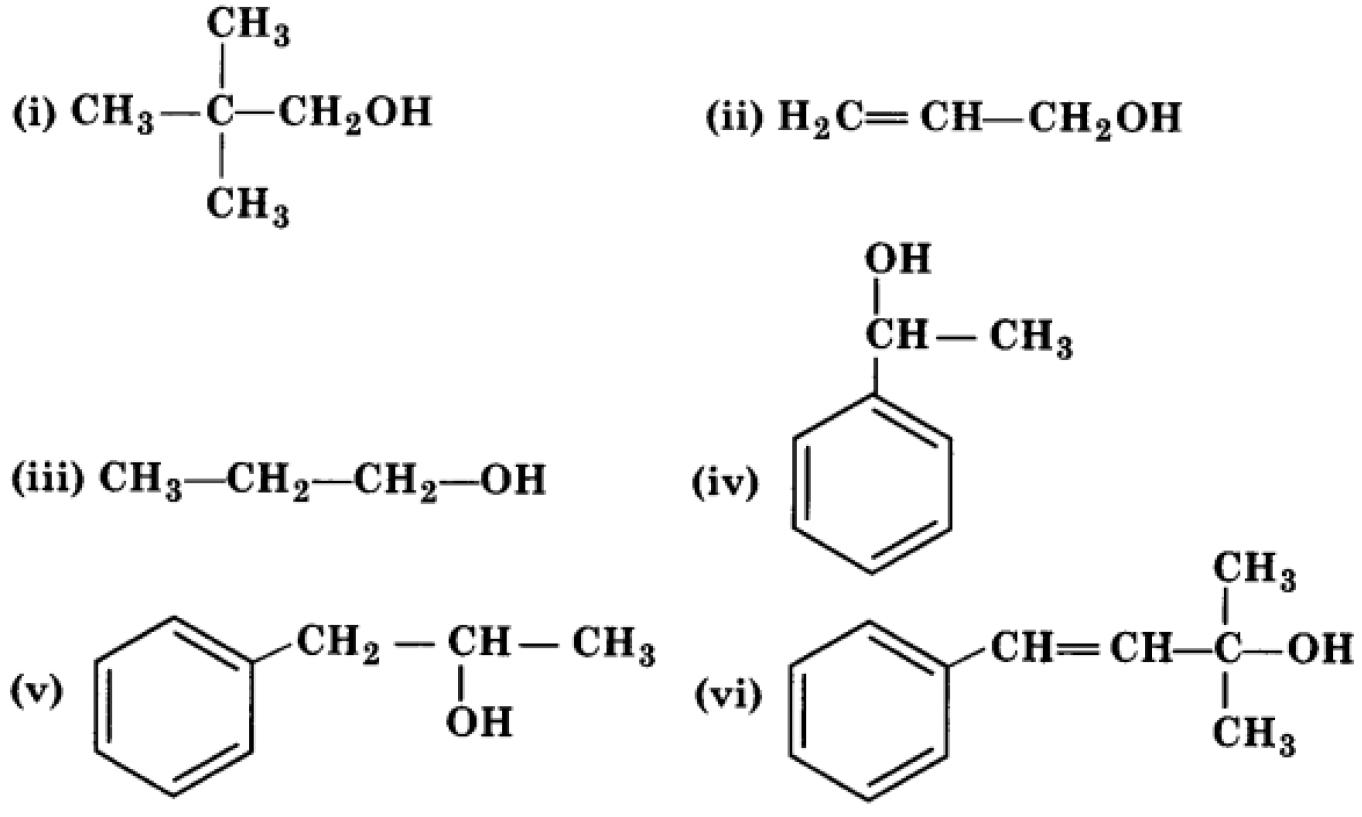
प्रश्न 3.निम्नलिखित को प्राथमिक, ्वितीयक एवं तृतीयक ऐल्कोहॉल में वर्गीकृत कीजिए –
उत्तर:-प्राथमिक ऐल्कोहॉल: (i),(ii),(iii) द्वितीयक ऐल्कोहॉल: (iv),(v) तृतीयक ऐल्कोहॉल:(vi)
प्रश्न 5. प्राथमिक ऐल्कोहॉल की तुलना में t-व्यूटिल ऐल्कोहॉल धात्विक सोडियम से कम तेजी से क्रिया करता है, क्यों?
उत्तरः तृतीयक ब्यूटिल ऐल्कोहॉल में केन्द्रीय C-परमाणु पर उपस्थित तीन -CH3 समूहों की उपस्थिति से + प्रभाव के कारण यह आंशिक ऋणावेशित हो जाता है जिसके परिणामस्वरूप यह 0-H के इलेक्ट्रॉन युग्म को हाइड्रोजन परमाणु की ओर धकेलता है, अतः H-परमाणु आसानी से प्रतिस्थापित नहीं होता है।
प्रश्न 6.C2H5OH तथा CH3OCH3 दोनों के अणुभार समान हैं किन्तु कमरे के ताप पर C2H5OH द्रव है तथा CH3OCH3 गैस है क्यों?
उत्तर: C2H5OH के अणुओं के मध्य अन्तराणुक हाइड्रोजन बन्ध बनता है जिसके कारण इसके अणुओं का संगुणन हो जाता है और यह द्रव अवस्था में रहता है जबकि CH3OCH3 के अणुओं के मध्य हाइड्रोजन बंध नहीं है इसलिए यह गैस है।
प्रश्न 7. निम्नलिखित यौगिकों के आई०्यू०पी०ए०सी० (IUPAC) नामपद्धति से नाम दीजिए
उत्तर:
(i) 3-क्लोरोमेथिल- 2-आइसोप्रोपिलपेण्टेन-1-ऑल
(ii) 2.5-डाइमेथिलहेक्सेन -1,3-डाइऑल
(iii) 3-ब्रोमोसाइक्लोहेक्सेनॉल
(iv) हेक्स-1-ईन-3-ऑल
(v) 2-ब्रोमो-3 मेथिलब्यूट-2-ईन – 1-ऑल
प्रश्न 8. दश्शाइए कि मेथेनल पर उपयुक्त ग्रीन्यार अभिकर्मक से अभिक्रिया द्वारा निम्नलिखित ऐल्कोहॉल कैसे विरचित किए जाते हैं?
उत्तरः
प्रश्न 9. निम्नलिखित अभिक्रियाओं में सम्मिलित समीकरण लिखिए –
1 राइमर-टीमैन अभिक्रिया
2. कोल्बे अभिक्रिया अथवा कोल्बे श्मिट अभिक्रिया।
3. डफ अभिक्रिया
4 .गाटरमान अभिक्रिया
उत्तरः
1. राइमर -टीमैन अभिक्रया (Reimer&Teimann Reaction) – फीनोल की सोडियम हाइड्रॉक्साइड की उपस्थिति में क्लोरोफॉर्म के साथ अभिक्रिया से बेन्जीन में,-CHO समूह ऑर्थों स्थिति पर प्रवेश कर जाता है। इस अभिक्रिया को राइमर – टीमैन अभिक्रिया कहते हैं ।प्रतिस्थापित मध्यवतीं बेंन्जिल क्लोराइड क्षार की उपस्थिति में अपघटित होकर सैलिसिलैल्डिहाइड बनाता है।
2.कोल्बे अभिक्रिया अथवा कोल्बे श्मिट अभिक्रिया (Kolbe’s Reaction or Kolbe Schmidt Reaction) – फीनॉल को सौडियमे हाइड्रॉक्साइड के साथ अभिकृत कराने से बना फीनॉक्साइड आयन, फीनोॉल की अपेक्षा इलेक्ट्रॉनरागी ऐरोमैटिक प्रतिस्थापन अभिक्रिया के प्रति अधिक क्रियाशील होता है। अतः यह C, जैसे दुर्बल इलेक्ट्रॉनरागी के साथ इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रिया करता है। इससे ऑथों-हाइड्रॉक्सीबेन्जोइक आम्ल मुख्य उत्पाद के रूप में प्राप्त होता है।
3.डफ अभेक्रिया (Duf Reaction);
फीनॉल को हैक्सामेथिलीन टेट्राऐमीन [(CH2)6N4) तथा बौरिक अम्ल (H3BO3) के साथ ग्लिसरॉल की उपस्थति में गर्म करने पर सैलिसैल्डिहाइड़ बनता है। यह अभिक्रिया डफ अभिक्रिया (duf Reaction) कहलाती है।
4.गाटरमान अभिक्रिया (Gatermann Reaction): फीनॉल की ZnCl2 उत्परेरक की उपस्थिति में HCN तथा HCI के मिश्रण के साथ अभिक्रिया कराने पर मध्यवर्ती के रूप में ऐल्डिमीन प्राप्त होता है। ऐल्डिमीन जलअपघटित होकर p-हाइड्रॉक्सी बेन्जैल्डिहाइड देता है। यह अभिक्रिया गाटरमान अभिक्रिया (Gattermann Reaction) कहलाती है।
प्रश्न 10. निम्नलिखित यौगिकों के आई०यू०पी०ए०सी० (1UPAC) नाम लिखिए –
उत्तरः
(i) 2, 2, 4-ट्राइमेथिलपेन्टेन-3-ऑल (ii) 5-एथिलहेप्टेन-2, 4-डाइऑल (iii) ब्यूटेन-2, 3- डाइऑल (iv) प्रोपेन-123-ट्राइऑल (v) 2- मेथिलफीनॉल (vi) 4- मेथिलफीनॉल (vii) 2.5-डाइमेथिलफोनॉल (viii) 2,6-डाइमेथिलफीनॉल (ix) 1- मेथॉक्सी-2- मेथिलप्रोपेन (x) एथोक्सीबेन्जीन (xi) 1-फीनॉक्सीहेप्टेन (xii) 2-एथॉक्सीब्यूटेन
प्रश्न 11.समझाइए कि प्रोपेनॉल का क्वथनांक, हाइड्रोकार्बन ब्यूटेन से अधिक क्यों होता है?
उत्तर: प्रोपेनॉल तथा ब्यूटेन लगभग समान अण् द्रव्यमान के होते हैं, लेकिन प्रोपेनॉल का क्वथनांक उच्च होता है, क्योंकि इसके अणुओं के मध्य अन्तरा-आण्विक हाइड्रोजन आबन्धन पाये जाते हैं। ब्यूटेन में धरुवीय -OH समूह की अनुपस्थिति के कारण H-आबन्धन नहीं पाये जाते हैं। ये परस्पर दुर्बल वाण्डरवाल आकर्षण बलों द्वारा जुड़े रहते हैं।
प्रश्न 12. क्लोरोबेन्जीन से फीनॉल बनाने की रासायनिक अभिक्रिया लिखिए।
उत्तर
प्रश्न 13.क्या होता है जब एथेनॉल को 453 K पर सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म किया जाता है? अभिक्रया की क्रियाविधि समझाइए।
उत्तर : जब एथेनॉल को 453 K पर सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म किया जाता है, तब एथीन बनती है।
‘प्रश्न 14.निम्नलिखित यौगिकों को अम्ल की बढ़ती हुई प्रबलता के क्रम में लिखिए
(i) Phenol (ii) o-Cresol (iii) m-Cresol (iv) p-Cresol
उत्तर: o-Cresol < p-Cresol < m-Cresol < Phenol अम्ल की प्रबलता का बढ़ता हुआ क्रम है।
प्रश्न 15.उदाहरण देते हुए समझाइए कि ईथर लूइस-बेस के समान व्यवहार करता है और अम्लों के साथ क्रिया करके औक्सोनियम लवण बनाता है।
उत्तरः ईथर अणु में ऑक्सीकरण परमाणु पर दो एकाकी इलेक्ट्रॉन युग्म उपस्थित होते हैं जिसके कारण यह प्रबल अम्लों के प्रति क्षारक जैसा व्यवहार प्रदर्शित करता है। ईथर (C2H5-O-C2H5) सान्द्र H2SO4 के साथ औक्सोनियम लवण बनाता है।
प्रश्न 16. प्राथमिक, द्वितीयक तथा तृतीयक ऐल्कोहॉलों में विभेद करने वाला एक रासायनिक परीक्षण लिखिए समीकरण भी दीजिए ।
या
ल्यूकास परीक्षण क्या है ? यह किस प्रकार के यौगिकों की पहचान में उपयोगी है?
उत्तरः
ल्यूकास परीक्षण – यह प्राइमरी, सेकण्डरी तथा टश्शियरी ऐल्कोहॉलों में विभेद करने की अत्यन्त सरल विधि है। यह भिन्न -भिन्न ऐल्कोहॉलों की ‘ल्यूकास अभिकर्मक’ (सान्द्र HCI, निर्जल ZnCl2) के प्रति भिन्न-भिन्न गति से अभिक्रिया करने पर आधारित है। किसी ऐल्कोहॉल में ल्यूकास अभिकर्मक मिलाने पर ऐल्किल क्लोराइड बनते हैं जिससे धुंधलापन उत्पन्न होता है। इस प्रकार,
1. कमरे के ताप पर टर्शियरी ऐल्कोहॉल तुरन्त धुंधलापन उत्पन्न करते हैं।
2. कमरे के ताप पर सेकण्डरी ऐल्कोहॉल 5-10 मिनट बाद धुंधलापन उत्पन्न करते हैं।
3. कमरे के ताप पर प्राइमरी ऐल्कोहॉल धुंधलापन उत्पन्न नहीं करते हैंय अतः विलयन पारदर्शक होता है।
प्रश्न 17. समझाइए -ऐल्कोहॉलों का अणुभार बढ़ने पर जल में इनकी विलेयता घटती है।
उत्तर: क्योंकि ऐल्किल समुह जलविरोधी होते हैं तथा जल में अविलेय हैं। निम्न ऐल्कोहॉल में ऐल्किल समूह छोटा होता है तथा ऐल्कोहॉल का -OH समूह अण को जल में विलेय बनाने में प्रबल रहता है। जैसे-जैसे ऐल्किल समूह का आकार बढ़ेता है उच्च अणुभार के ऐल्कोहॉलों में ऐल्किल समूह की जल विरोधी प्रकृति -OH समूह की जल स्नेही प्रकृति पर प्रभावी होती जाती है इसलिए विलेयता घटती है।
प्रश्न 18, हाइड्रोजन आयोडाइड की निम्नलिखित के साथ अभिक्रिया के लिए समीकरण लिखिए –
(i) 1-प्रोपॉक्सीप्रोपेन (ii) मे्थॉक्सीबेन्जीन तथा (iii) बेन्जिल एथिल ईथर।
प्रश्न 19.ग्रीन्यार अभिकर्मक की अभिक्रिया फॉर्मेल्डिहाइड से कराने पर बनने वाले उत्पाद का नाम लिखिए।
उत्तरः
प्राथामिक ऐल्कोहाॉले
प्रश्न 20. डाइऐथिलईथर की हैलोजेनीकरण अभिक्रिया समझाइए
उत्तरः डाइऐथिल ईथर की हैलोजेनीकरण असिक्रिया (alog9nation Reaction of Diethyl Ether)क्लोरीन अथवा ब्रोमीन के साथ गर्म करने पर डाई ऐथिल ईथर के कार्बन पर उपस्थित हाइड्रोजन परमाणु हैलोजन परमाणु से प्रतिस्थापित हो जाते हैं।
(i) अन्धेरे में हैलोजेनीक्रण से α, α’-डाइ हैलो ईथर प्राप्त होता है।
(i) सूर्य के प्रकाश में डाइऐथिल ईथर क्लोरीन से अभिक्रिया करके। परक्लोरो डाई ऐथिल ईथर बनाता है।
प्रश्न 21.ऐल्कोहॉल निम्न से अभिक्रिया करके क्या बनाता है?
(i) PCl3 (ii) SOCl2
उत्तरः
(i) PCl3 से अभिक्रिया (Reaction with PCl3)
(ii) SOCl2 से अभिक्रिया (Reaction with SOCl2)
ऐल्कोहॉल पिरीडीन की उपस्थिति में थायोनिल क्लोराइड से अभिक्रिया करकै ऐल्किल क्लोराइड बनाते हैं।
प्रश्न 22. हाइड्रोबोरॉनीकरण-ऑक्सीकरण अभिक्रिया से आप क्या समझते हैं? इसे उदाहरण सहित समझाइए।
उत्तरः डाइबोरेन का ऐल्कीनों सें योग द्वारा दट्राइऐल्किलबोरेन का निर्माण तथा इसके क्षारीय H2O2 द्वारा ऑक्सीकरण से ऐल्कोहॉल का निर्माण, यह अभिक्रिया हाइड्रोबोरॉनीकरण-ऑक्सीकरण कहलाती है।
प्रश्न 23.ऑर्थों तथा पैरा नाइट्रोफीनॉलों के मिश्रण को भाप -आसवन द्वारा पृथक करने में भाप-वाष्पशील समावयवी का नास् बताइए। इसका कारण दीजिए।
उत्तर p-नाइट्रोफीनॉल अन्तःअणुक् हाइड्रोजन आबन्धन (intra & molecular hydrogen bonding) के कारण भाप वाष्पशील होता है, जबकि p-नाइट्रोफीनोल अन्तरा-अणुक हाइड्रोजन आबन्धन (intermolecular hydrogen bonding) के कारण कम वाष्पशील होता है।